【題目】I.現(xiàn)有三個反應:
反應①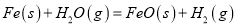
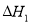 =a kJ/mol平衡常數(shù)為K1
=a kJ/mol平衡常數(shù)為K1
反應②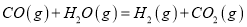
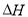 平衡常數(shù)為K2
平衡常數(shù)為K2
反應③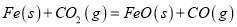
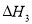 =b kJ/mol平衡常數(shù)為K3
=b kJ/mol平衡常數(shù)為K3
在不同溫度下�����,部分K1����、K2的值如下:
T/℃ | 700 | 800 |
K1 | 2.38 | 2.56 |
K2 | 0.80 |
|
(1) 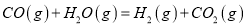
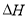 ==____________________
==____________________
(2)K1的表達式為____________����;根據(jù)反應①��、②���、③推導出K1、K2���、K3的關系式K3=______________����。
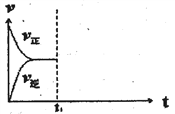
(3)在恒溫恒壓密閉容器中通入CO和H2O各1mol發(fā)生反應②����,當反應達到平衡后,維持溫度與壓強不變����,t1時再通入各1mol的CO和H2O的混合氣體,請在下圖中畫出正(v正)����、逆(v逆)反應速率在t1后隨時間t變化的曲線圖_______。
Ⅱ.在容積相同的兩個密閉容器內(nèi)(裝有等量的某種催化劑)���,分別充入同量的NOx及C3H6����,在不同溫度下,同時發(fā)生以下反應:
18NO(g)+2C3H6(g) 9N2(g)+6CO2(g)+6H2O(g):
18NO2(g)+4C3H6(g) 9N2(g)+12CO2(g)+12H2O(g)����;
并分別在t秒時測定其中NOx轉(zhuǎn)化率�����,繪得圖像如下圖所示:
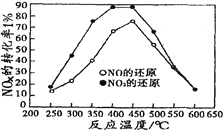
①從圖中可以得出的結(jié)論是
結(jié)論一:從測定NOx轉(zhuǎn)化數(shù)據(jù)中判斷�,相同溫度下NO轉(zhuǎn)化效率比NO2的低���。
結(jié)論二:________________________________________________________
②在上述NO2和C3H6反應中�,提高NO2轉(zhuǎn)化率的措施有_____________���。(填編號)
A.加入催化劑 B.降低溫度 C.分離出H2O(g) D.增大壓強
Ⅲ.常溫常壓下�����,空氣中的CO2溶于水�,達到平衡時,溶液的pH=5.6���,c(H2CO3)=1.5×10 -5 mol/L����。若忽略水的電離及H2CO3的第二級電離��,則H2CO3HCO3-+ H+ 的平衡常數(shù)K1=___________����。(已知:10-5.60=2.5×10-6 )