
科目: 來源: 題型:
| A.維生素A | B.維生素B | C.維生素C | D.胡蘿卜素 |
查看答案和解析>>
科目: 來源: 題型:
| A.白細(xì)胞 | B.紅細(xì)胞 | C.血小板 | D.血細(xì)胞 |
查看答案和解析>>
科目: 來源: 題型:
查看答案和解析>>
科目: 來源: 題型:
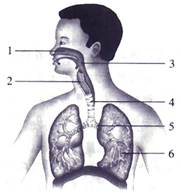
查看答案和解析>>
科目: 來源: 題型:
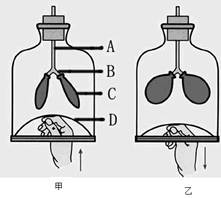
查看答案和解析>>
科目: 來源: 題型:
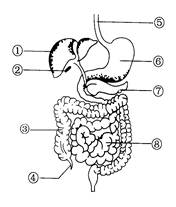
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權(quán)舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com