���P���}
0 11071 11079 11085 11089 11095 11097 11101 11107 11109 11115 11121 11125 11127 11131 11137 11139 11145 11149 11151 11155 11157 11161 11163 11165 11166 11167 11169 11170 11171 11173 11175 11179 11181 11185 11187 11191 11197 11199 11205 11209 11211 11215 11221 11227 11229 11235 11239 11241 11247 11251 11257 11265 203614
��Ŀ��
��Դ��0114 �¿��}
�}�ͣ����x�}
�±����Ǹ��M�����ķ�����͜ضȣ��������_ʼ�r���ų�H2����������
�� �� ���٣���ĩ����|(zh��)������mol���� ��ĝ�ȼ��w�e�� �� �����ض�(��)
A���� �� �� �� Mg��0.1�� �� �� �� �� 8mol��L-1���������10mL�� �� �� 60
B���� �� �� �� Mg�������0.1�� �� �� �� �� 3mol��L-1��������}��10mL�� �� �� 60
C���� �� �� �� Fe������0.1�� �� �� �� �� 3mol��L-1����}��10mL�� �� �� 60
D���� �� �� �� Mg��0.1�� �� �� �� �� 3mol��L-1�������10mL�� �� �� 60
�鿴�𰸺ͽ���>>
��Ŀ��
��Դ��0114 �¿��}
�}�ͣ����x�}
��ijһ���淴�����f��ʹ�ô�����������
A����߷������ƽ���D(zhu��n)����
B����ͬ�ӳ̶ȸ�׃���淴������
C���������������������������淴������
D����׃ƽ������ĽM��
�鿴�𰸺ͽ���>>
��Ŀ��
��Դ��0114 �¿��}
�}�ͣ�����}
�U�fӡˢ�·��Ļ������ÿɌ��F(xi��n)�YԴ������������p����Ⱦ����U�fӡˢ�·�彛(j��ng)������x�������ܵõ��ǽ��ٷ�ĩ�ͽ��ٷ�ĩ������
��1������̎��ӡˢ�·��ǽ��ٷ�ĩ�ķ�������������ϭh(hu��n)�����o�������___________������ĸ����
A�����ѽ��γ�ȼ�� B��¶��ٟ� C�������ЙC�ͺϽ������ϵ�ԭ�� D��ֱ������
��2����H2O2��H2SO4�Ļ����Һ���ܳ�ӡˢ�·����ٷ�ĩ�е��~�����֪��
Cu(s)+2H+(aq)====Cu2+(aq) +H2(g) ��H=+64��39kJ/mol
2H2O2(l)====2H2O(l)+O2(g) ��H=-196��46kJ/mol
H2(g)+1/2O2(g)====H2O(l) ��H=-285��84kJ/mol
��H2SO4��Һ��Cu�cH2O2��������Cu2+��H2O�ğữ����ʽ��________________________��
��3�����������l����ͬ�������ӡˢ�·��Ľ��ٷ�ĩ��10��H2O2��3��0mol��L-1 H2SO4�Ļ����Һ̎���������y�ò�ͬ�ض����~��ƽ���ܽ����ʣ�Ҋ�±�����
���ضȸ���40��r��������~��ƽ���ܽ������S�������ض����߶��½������������Ҫԭ����___________________�����
��4�����ἃ���CuSO4��Һ�м���һ������Na2SO3��NaCl��Һ������ӟ�����������CuCl��������Ƃ�CuCl���x�ӷ���ʽ��_____________________��
�鿴�𰸺ͽ���>>
��Ŀ��
��Դ��0114 �¿��}
�}�ͣ�����}
Ӱ푻��W�������ʵ����غܶ������ij�n���dȤС�M�Ì��ķ���ͨ�^�D1��ʾ�b���о��������ʵ����P���}������
��1��ȡһ���V�l���������ɰ����ȥ���������Ĥ�������ʹ�V�l�����F��ƿ��(n��i)������ϡ�}��������������V�l�cһ�����}�ᷴ������H2�����c�����r�g���Pϵ������D2��ʾ������ԓ�������x�ӷ���ʽ___________________________________________���������ǰ4min��(n��i)���V�l�c�}��ķ���������u�ӿ��������4min֮�������������������u�p�����Ո������ԭ��____________________________________________ ���
��2��ijͬ�W�l(f��)�F(xi��n)�������������|(zh��)��������e����ͬ�ă��XƬ�cH+�����ͬ���}���������ͬ��ͬ���·����r�a(ch��n)���������ʲ�e�ܴ��������X���}�ᷴ�����ʸ��졣���Q������ԭ���M��̽�������������пհף�
��ԓͬ�W�J�飺�����A�ȿ����˷����������l������ô�������ɴΌ��r���������ʲ�һ�ӵ�ԭ��ֻ��������N���ܣ�
ԭ���Cl-���������д��M������������SO42-�������]��Ӱ푣�
ԭ���_______________________________________________________���
ԭ���Cl-���������д��M���ã���SO42-������������K���������
ԭ�����Cl-�����SO42-�����������д��M���ã���Cl-Ӱ푸���������
ԭ�����________________________________________________________��
��ԓͬ�W�OӋ���M���˃ɽM������������ó������_�Y(ji��)Փ����ȡ�˃�Ƭ���|(zh��)����������κͽM����ͬ����������潛(j��ng)�^ɰ����ִ�ĥ���XƬ��������քe���뵽ʢ��ͬ�w�e�������c(H+)��ͬ��ϡ������}���ԇ�ܣ���ԇ�ܵ�Ҏ(gu��)����ͬ���У�
a����ʢ�������ԇ���м�������NaCl��KCl���w��������^�췴�������Ƿ�׃�����
b����ʢ���}���ԇ���м�������Na2SO4��K2SO4���w��������^�췴�������Ƿ�׃�����
���^�쵽���a��____________�����b��____________������t�f��ԭ��������_�����������������������ԓͬ�Wͨ�^�������F(xi��n)��������ó��˽Y(ji��)Փ��Cl-���������м����������
�鿴�𰸺ͽ���>>
��Ŀ��
��Դ��0118 �¿��}
�}�ͣ����x�}
100mL 6mol��L-1 H2SO4���^���\�۷���������һ���ض��£����˜p�������M�е��������������ֲ�Ӱ����ɚ��Ŀ������������м����m��
A��̼���c(���w)
B��ˮ
C�������(���w)
D�������@(���w)
�鿴�𰸺ͽ���>>
��Ŀ��
��Դ��0118 �¿��}
�}�ͣ����x�}
�����f�����_����
A�����������������������λ�w�e��(n��i)����Ӱٷ֔�(sh��)���Ķ�ʹ��Ч��ײ�Δ�(sh��)����
B���К��w���ӵĻ��W��������������������sС�����������w�e����������ӻ���ӵİٷ֔�(sh��)���Ķ�ʹ������������
C�����ߜض���ʹ���W�������������������Ҫԭ���������˷���������л���ӵİٷ֔�(sh��)
D��������Ӱ푷�����ܵ��������λ�w�e��(n��i)����Ӱٷ֔�(sh��)���Ķ���������
�鿴�𰸺ͽ���>>
��Ŀ��
��Դ��0119 �¿��}
�}�ͣ�����}
2007���Zؐ�����W��������ƌW�ҹ��¡����ؠ�������Ա������ڱ��滯�W�о��I���������_����ؕ�I����������滯�W�I����о����Ԏ����҂��˽ⱊ�༊�s�Ļ��W�^������������F��Ε����P�������ȼ��늳���������Լ�ijЩ�����Ĵ�������ΰl(f��)�]�书�ܵ���������������Խ�ጳ����ӵ����ĵ����
��1��ij���������W�о��ԌW��С�M��ͬ�W�ڼ��g(sh��)�ˆT��ָ�����������������̽����ͬ������NH3߀ԭNO�����Ĵ����ܡ�
�������������l������ͬ������ڴ����������b�в�ͬ�Ĵ��������������(j��ng)��������Ļ�Ϛ��wͨ�^���з�̪��ϡ������Һ����Һ���w�e�͝�Ⱦ���ͬ������������^��ͬ�����Ĵ����������Ҫ�y����ӛ䛵Ĕ�(sh��)��(j��)��________________��
��2������܇���Ś���ϰ��b�����D(zhu��n)�Q���������K������Z�Ͻ����������������������ʹCO������NO�������ɿ����c���h(hu��n)����ѭ�h(hu��n)�ğo�����w������ʹ�N����|(zh��)���ȼ�����
����CO��NO�����Ļ��W����ʽ��________________���ԓ�������������������|(zh��)��___________������
��CH4��߀ԭNOxҲ�����������������Ⱦ�����磺
CH4��g��+4NO2��g��==4NO��g��+CO2��g��+2H2O��g����������H1=-574kJ/mol
CH4��g��+4NO��g��==2N2��g��+CO2��g��+2H2O��g�����������H2
��1molCH4߀ԭNO2��N2�����������^���зų��ğ�����867kJ���t��H2=________________�������
��3���������J�飺ԓ��о�����ʹ���ĺϳɷ������F���������M�ЕrЧ�ʴ�������������Ķ�ʹԭ�������ʴ������������Ո�㑪�û��W������Փ�����^�c�M���u�r��________________________________��
�ںϳɰ����I(y��)���a(ch��n)�����õĦ�-Fe��������Ҫ�ɷ���FeO������Fe2O3����������Fe2+�cFe3+�����|(zh��)����֮�Ȟ�1�U2�r������������������Fe2O3��ԭ���Ƃ�����������������������м����m����̿��������l(f��)���������£�2Fe2O3+C==4FeO+CO2���Ƶ��@�N�������Ĵ������������480g Fe2O3��ĩ�м���̿�۵��|(zh��)����
________________
�鿴�𰸺ͽ���>>
��Ŀ��
��Դ��0118 �¿��}
�}�ͣ����x�}
������4�NNa2S2O3����Һ�քe����4��ʢ��10mL 2mol��L-1����ğ����У�����ˮϡጵ�50mL����˕r��
Na2S2O3�������M����������F(xi��n)����������
A��20mL 3mol��L-1Na2S2O3����Һ
B��20mL 2mol��L-1Na2S2O3����Һ
C��10mL 4mol��L-1Na2S2O3����Һ
D��10mL 2mol��L-1Na2S2O3����Һ
�鿴�𰸺ͽ���>>
��Ŀ��
��Դ��0118 �¿��}
�}�ͣ����x�}
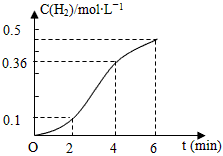
��֪һ���|(zh��)�����\���cϡ�}�ᷴ�����şᷴ����������H2�ĝ���c�����r�g���Pϵ���D��ʾ����������нY(ji��)Փ�����_����
A�����\���Ğ��\�ۣ����Լӿ�a(ch��n)��H2������
B��������2��4min��(n��i)ƽ�������������
C������ǰ4min��(n��i)����H2��ƽ������v(H2)=0��09mol��L-1��min-1
D�������_ʼ2min��(n��i)ƽ�������������
�鿴�𰸺ͽ���>>
��Ŀ��
��Դ��0118 �¿��}
�}�ͣ����x�}
���FƬ�cϡ���ᷴ����ȡ���r��������д�ʩ����ʹ����������ʼӴ����
A����ԓ�����wϵ�ӟ�
B������ϡ�������������98%������
C���μ�����CuSO4��Һ
D�������FƬ�������F��
�鿴�𰸺ͽ���>>