
題目列表(包括答案和解析)
| ||
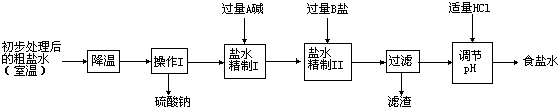
| 溫度 | NH4Cl | NH4HCO3 | NaHCO3 | NaCl |
| 30℃ | 41.1g | 27.0g | 11.1g | 36.3g |
| ||
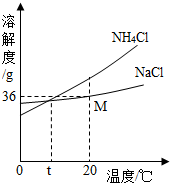 我國科學家侯德榜創(chuàng)造了一種著名的純堿生產方法-“聯合制堿法”.請你回答:
我國科學家侯德榜創(chuàng)造了一種著名的純堿生產方法-“聯合制堿法”.請你回答:
| ||
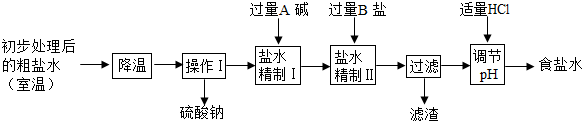

| 實驗操作 | 實驗現象 | 實驗結論 |
| |
| 溫度 | NH4Cl | NH4HCO3 | NaHCO3 | NaCl |
| 30℃ | 41.1g | 27.0g | 11.1g | 36.3g |
| ||
| ||
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com