
題目列表(包括答案和解析)
| 實驗 編號 |
溫度/℃ | 大理石 規(guī)格 |
HCl的質(zhì)量分數(shù) | 完全反應的時間/s | 實驗目的 |
| ① | 25 | 粗顆粒 | 20% | 160 | (I)實驗①和②探究同體積下HCl質(zhì)量分數(shù)對該反應劇烈程度的影響. (II)實驗①和③探究溫度對該反應劇烈程度的影響. (Ⅲ)實驗①和④探究大理石規(guī)格對該反應劇烈程度的影響. |
| ② | 210 | ||||
| ③ | 35 | 粗顆粒 | 20% | 60 | |
| ④ | 100 |
| 實驗編號 | T/℃ | 大理石 規(guī)格 |
HCl的質(zhì)量分數(shù) | 完全反應的 時間/s |
實驗目的 |
| ① | 25 | 粗顆粒 | 18.25% | 160 | (Ⅰ)實驗①和②探究同體積下HCl的質(zhì)量分數(shù)對該反應劇烈程度的影響. (Ⅱ)實驗①和③探究溫度對該反應劇烈程度的影響. (Ⅲ)實驗①和④探究大理石規(guī)格對該反應劇烈程度的影響. |
| ② | 210 | ||||
| ③ | 35 | 粗顆粒 | 18.25% | 60 | |
| ④ | 100 |
| 實驗 編號 | 溫度/℃ | 大理石 規(guī)格 | HCl的質(zhì)量分數(shù) | 完全反應的時間/s | 實驗目的 |
| ① | 25 | 粗顆粒 | 20% | 160 | (I)實驗①和②探究同體積下HCl質(zhì)量分數(shù)對該反應劇烈程度的影響. (II)實驗①和③探究溫度對該反應劇烈程度的影響. (Ⅲ)實驗①和④探究大理石規(guī)格對該反應劇烈程度的影響. |
| ② | 210 | ||||
| ③ | 35 | 粗顆粒 | 20% | 60 | |
| ④ | 100 |
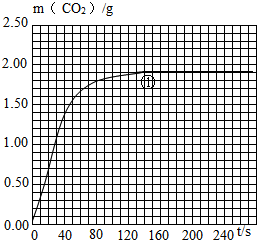
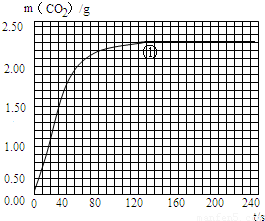
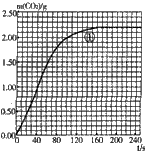
| 實驗編號 | T/℃ | 大理石 規(guī)格 | HCl的質(zhì)量分數(shù) | 完全反應的 時間/s | 實驗目的 |
| ① | 25 | 粗顆粒 | 18.25% | 160 | (Ⅰ)實驗①和②探究同體積下HCl的質(zhì)量分數(shù)對該反應劇烈程度的影響. (Ⅱ)實驗①和③探究溫度對該反應劇烈程度的影響. (Ⅲ)實驗①和④探究大理石規(guī)格對該反應劇烈程度的影響. |
| ② | ______ | ______ | ______ | 210 | |
| ③ | 35 | 粗顆粒 | 18.25% | 60 | |
| ④ | ______ | ______ | ______ | 100 |
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權(quán)舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com