(三選一)【化學(xué)與技術(shù)】
2011年8月12日�����,網(wǎng)上傳云南曲靖市越州鎮(zhèn)有總量5000余噸的重毒化工廢料鉻渣由于非法丟放,毒水被直接排放南盤江中���。
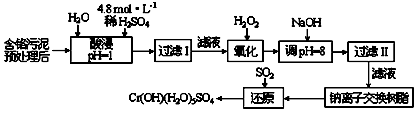
Ⅰ:某工廠對(duì)制革工業(yè)污泥中Cr(III)回收與再利用工藝如下(硫酸浸取液中金屬離子主要是Cr3+�,其次是Fe3+����、Al3+、Ca2+����、Mg2+)
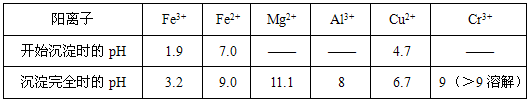
部分陽離子常溫下以氫氧化物形式沉淀時(shí)溶液的pH見下表
(1)實(shí)驗(yàn)室用18.4 mol/L的濃硫酸配制250 mL 4.8 mol/L的硫酸溶液,所用的玻璃儀器除燒杯���、玻璃棒和吸量管(一種能精確量取一定體積液體的儀器)外�,還需____________�。
(2)酸浸時(shí),為了提高浸取率可采取的措施是______________(至少答一點(diǎn))�����。
(3)加入H2O2的作用是__________________________�,調(diào)節(jié)溶液的pH=8是為了除去_________離子。
(4)鈉離子交換樹脂的原理為:Mn++nNaR→MRn+nNa+����,被交換的的雜質(zhì)離子是____________。
(5)還原過程發(fā)生以下反應(yīng)(請(qǐng)配平): _____Na2Cr2O7+_____SO2+____ ________ = ____ Cr(OH)(H2O)5SO4+_______Na2SO4�;
Ⅱ:工業(yè)廢水中常含有一定量的Cr2O72-和CrO42-,它們會(huì)對(duì)人類及生態(tài)系統(tǒng)產(chǎn)生很大損害��,必須進(jìn)行處理�����。其中一種處理方法為電解法:該法用Fe做電極����,電解含Cr2O72-的酸性廢水,隨著電解進(jìn)行���,陰極附近溶液pH升高�,產(chǎn)生Cr(OH)3沉淀���。
(6)陽極的電極反應(yīng)式為_______________�。在陰極附近溶液pH升高的原因是(用電極反應(yīng)方程式解釋)__________。