
題目列表(包括答案和解析)
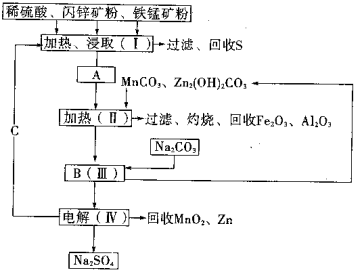 (2011?湖南模擬)某工廠用軟錳礦(含MnO2約70%及少量Al2O3)和閃鋅礦(古ZnS約80%及少量FeS)共同生產(chǎn)MnO2和Zn(干電池原料)生產(chǎn)工藝如下:
(2011?湖南模擬)某工廠用軟錳礦(含MnO2約70%及少量Al2O3)和閃鋅礦(古ZnS約80%及少量FeS)共同生產(chǎn)MnO2和Zn(干電池原料)生產(chǎn)工藝如下: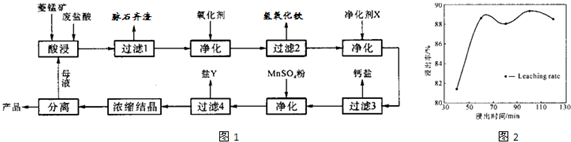
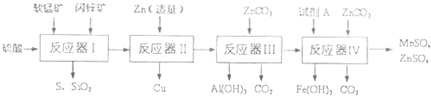
| 物質(zhì) | Fe(OH)3 | A1(OH)3 | Zn(OH)2 | Fe(OH)2 | Mn(OH)2 |
| 開始沉淀pH | 2.7 | 3.3 | 5.4 | 7.6 | 8.3 |
| 完全沉淀pH | 4.4 | 5.2 | 8.0 | 9.6 | 9.8 |

| 反應(yīng)時(shí)間(h) | 1 | 2 | 3 | 4 | 5 |
| 苯甲醛產(chǎn)率(%) | 76.0 | 87.5 | 83.6 | 72.5 | 64.8 |
| ||
| △ |
| ||
| 加入藥品 | 不加MnSO4的硫酸 酸化的H2C2O4溶液 |
加少量MnSO4的硫酸 酸化的H2C2O4溶液 |
| 實(shí)驗(yàn)現(xiàn)象 (褪色時(shí)間)/s |
H2C2O4褪色很慢 (31秒) |
H2C2O4褪色很快(4秒) |
百度致信 - 練習(xí)冊(cè)列表 - 試題列表
湖北省互聯(lián)網(wǎng)違法和不良信息舉報(bào)平臺(tái) | 網(wǎng)上有害信息舉報(bào)專區(qū) | 電信詐騙舉報(bào)專區(qū) | 涉歷史虛無(wú)主義有害信息舉報(bào)專區(qū) | 涉企侵權(quán)舉報(bào)專區(qū)
違法和不良信息舉報(bào)電話:027-86699610 舉報(bào)郵箱:58377363@163.com