
題目列表(包括答案和解析)
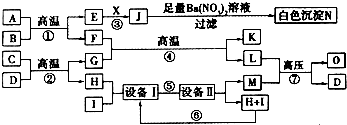
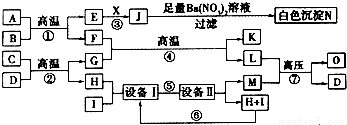

| ||
| ||
| ||
| ||
| ||
| ||
| 元素 | W | X | Y | Z |
| 原子半徑 | 186pm | 99pm | 66pm | 77pm |
| 核外電子 | 有4種能級不同的電子 | 最外層有7種運動狀態(tài)不同的電子 | 核外電子占有5個軌道 | 有2個未成對電子 |
| 單質(zhì) 部分 性質(zhì) | 密度:0.97g?cm-3 熔點:97.8℃ 能導電 | 沸點:-34.0℃ 不能導電 | 密度:1.43g?L-1 沸點:-183.0℃ 不能導電 | 熔點:3550℃ 能導電 |
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權(quán)舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com