
�}Ŀ�б�(�����𰸺ͽ���)
 ��Դ���������Ͱl(f��)չ����Ҫ֧�����о�����Ч���_�l(f��)����Դ����Դ�oȱ�Ľ��������Ҫ����Փ���x����֪H2�cCO��������CH3OH���^����D��ʾ��CO��ȼ�����H2=-bkJ?mol-1��CH3OH��ȼ�����H3=-ckJ?mol-1��Ո����(j��)������Ϣ���ش��������P���}��
��Դ���������Ͱl(f��)չ����Ҫ֧�����о�����Ч���_�l(f��)����Դ����Դ�oȱ�Ľ��������Ҫ����Փ���x����֪H2�cCO��������CH3OH���^����D��ʾ��CO��ȼ�����H2=-bkJ?mol-1��CH3OH��ȼ�����H3=-ckJ?mol-1��Ո����(j��)������Ϣ���ش��������P���}��| a+c-b |
| 2 |
| a+c-b |
| 2 |
| e |
| 2 |
| e |
| 2 |
| �ζ��Δ�(sh��) | ���yҺ�w�e ��mL�� |
�˜��}���w�e��mL�� | |
| �ζ�ǰ�x��(sh��)��mL�� | �ζ����x��(sh��)��mL�� | ||
| ��һ�� | 10.00 | 0.50 | 20.40 |
| �ڶ��� | 10.00 | 4.00 | 24.10 |

| a | |||||||||||||||||
| b | c | d | e | f | |||||||||||||
| g | h | i | j | k | l | m | |||||||||||
| n | o | ||||||||||||||||
 NH3?H2O+H+
NH3?H2O+H+ NH3?H2O+H+
NH3?H2O+H+

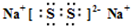
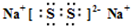


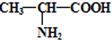
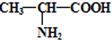

| ||
| ||
����ʡ��(li��n)�W(w��ng)�`���Ͳ�����Ϣ�e��ƽ�_ | �W(w��ng)���к���Ϣ�e�^(q��) | ����p�_�e�^(q��) | ��vʷ̓�o���x�к���Ϣ�e�^(q��) | �����֙��e�^(q��)
�`���Ͳ�����Ϣ�e���Ԓ��027-86699610 �e���]�䣺58377363@163.com