
�}Ŀ�б�(�����𰸺ͽ���)
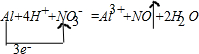
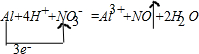
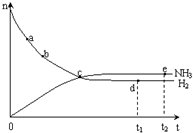 �ϳɰ����I(y��)��(du��)����(j��ng)��(j��)�����(hu��)�l(f��)չ������Ҫ�����x�� �ϳ����аl(f��)������(y��ng)�飺
�ϳɰ����I(y��)��(du��)����(j��ng)��(j��)�����(hu��)�l(f��)չ������Ҫ�����x�� �ϳ����аl(f��)������(y��ng)�飺| T/K | T1 | 573 | T2 |
| K | 1.00��107 | 2.45��105 | 1.88��103 |
�ٶ����� - ����(x��)���б� - ԇ�}�б�
����ʡ��(li��n)�W(w��ng)�`���Ͳ�����Ϣ�e��(b��o)ƽ�_(t��i) | �W(w��ng)���к���Ϣ�e��(b��o)���^(q��) | ����p�_�e��(b��o)���^(q��) | ��vʷ̓�o���x�к���Ϣ�e��(b��o)���^(q��) | �����֙�(qu��n)�e��(b��o)���^(q��)
�`���Ͳ�����Ϣ�e��(b��o)�Ԓ��027-86699610 �e��(b��o)�]�䣺58377363@163.com