
題目列表(包括答案和解析)
| 周期 族 | IA | 0 | |||||||
| 1 | 1 H 氫 1.008 |
2 He 氦 4.003 |
|||||||
| IIA | IIIA | IVA | VA | VIA | VIIA | ||||
| 2 | 3 Li 鋰 6.941 |
4 Be 鈹 9.012 |
5 B 硼 10.81 |
6 C 碳 12.01 |
7 N 氮 14.01 |
8 O 氧 16.00 |
9 F 氟 19.00 |
10 Ne 氖 20.18 |
|
| 3 | 11 Na 鈉 22.99 |
12 Mg 鎂 24.31 |
13 Al 鋁 26.98 |
14 Si 硅 28.09 |
15 P 磷 30.97 |
16 S 硫 32.06 |
17 Cl 氯 35.45 |
18 Ar 氬 39.95 |
|
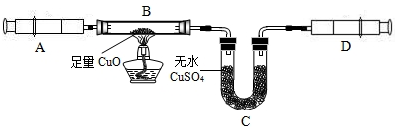
| 現(xiàn) 象 | 反應前質(zhì)量(g) | 反應后質(zhì)量(g) | |
| B裝置中 | 逐漸變成亮紅色 | 21.32 | 21.08 |
| C裝置中 | 變藍色 | 32.16 | 32.43 |
| 氣 體 | H2 | O2 | CO | CH4 | N2 | CO2 |
| 常溫常壓時的密度(g/L) | 0.09 | 1.43 | 1.25 | 0.72 | 1.25 | 1.98 |
| 1 H 1.008 |
2 He 4.003 | |||||||
| 3 Li 6.941 |
4 Be 9.012 |
5 B 10.81 |
6 C 12.01 |
7 N 14.01 |
8 O 16.00 |
9 F 19.00 |
10 Ne 20.18 | |
| 11 Na 22.99 |
12 Mg 24.31 |
… | 13 Al 26.98 |
14 Si 28.09 |
15 P 30.97 |
16 S 32.06 |
17 Cl 35.45 |
18 Ar 39.95 |
| 1 H 1.008 |
2 He 4.003 | |||||||
| 3 Li 6.941 |
4 Be 9.012 |
5 B 10.81 |
6 C 12.01 |
7 N 14.01 |
8 O 16.00 |
9 F 19.00 |
10 Ne 20.18 | |
| 11 Na 22.99 |
12 Mg 24.31 |
… | 13 Al 26.98 |
14 Si 28.09 |
15 P 30.97 |
16 S 32.06 |
17 Cl 35.45 |
18 Ar 39.95 |
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權(quán)舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com