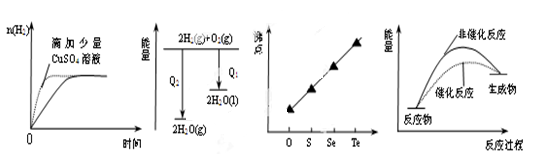
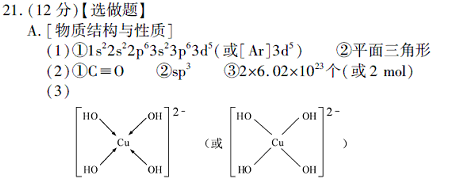
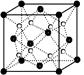
闂傚倸鍊搁崐鎼佸磹閹间礁纾归柟闂寸绾惧綊鏌熼梻瀵割槮缁炬儳缍婇弻鐔兼⒒鐎靛壊妲紒鐐劤濠€閬嶅焵椤掑倹鍤€閻庢凹鍙冨畷宕囧鐎c劋姹楅梺鍦劋閸ㄥ綊宕愰悙宸富闁靛牆妫楃粭鍌滅磼閳ь剚绗熼埀顒€鐣峰⿰鍫晣闁绘垵妫欑€靛矂姊洪棃娑氬婵☆偅顨嗛幈銊槾缂佽鲸甯¢幃鈺呭礃閼碱兛绱濋梻浣虹帛娓氭宕抽敐鍡樺弿闁逞屽墴閺屾洟宕煎┑鍥舵¥闂佸憡蓱閹瑰洭寮婚埄鍐ㄧ窞閻忕偞鍨濆▽顏呯節閵忋垺鍤€婵☆偅绻傞悾宄扳攽閸♀晛鎮戦梺绯曞墲閸旀帞鑺辨繝姘拺闁告繂瀚埀顒佹倐閹ê鈹戠€e灚鏅滃銈嗗姂閸婃澹曟總绋跨骇闁割偅绋戞俊鐣屸偓瑙勬礀閻ジ鍩€椤掑喚娼愭繛鍙夅缚閺侇噣骞掑Δ瀣◤濠电娀娼ч鎰板极閸曨垱鐓㈡俊顖欒濡插嘲顭跨憴鍕婵﹥妞藉畷銊︾節閸曨厾绐楅梻浣呵圭€涒晜绻涙繝鍥х畾閻忕偠袙閺嬪酣鏌熼幆褜鍤熼柛姗€浜跺娲传閸曨剙鍋嶉梺鍛婃煥閻倿骞冨鈧幃鈺呮偨閻㈢绱查梻浣虹帛閻熴垽宕戦幘缁樼厱闁靛ǹ鍎抽崺锝団偓娈垮枛椤攱淇婇幖浣哥厸闁稿本鐭花浠嬫⒒娴e懙褰掑嫉椤掑倻鐭欓柟杈惧瘜閺佸倿鏌ㄩ悤鍌涘婵犵數濮烽弫鍛婃叏閻戣棄鏋侀柛娑橈攻閸欏繘鏌i幋锝嗩棄闁哄绶氶弻娑樷槈濮楀牊鏁鹃梺鍛婄懃缁绘﹢寮婚敐澶婄闁挎繂妫Λ鍕⒑閸濆嫷鍎庣紒鑸靛哺瀵鎮㈤崗灏栨嫽闁诲酣娼ф竟濠偽i鍓х<闁诡垎鍐f寖缂備緡鍣崹鎶藉箲閵忕姭妲堥柕蹇曞Х椤撴椽姊洪崫鍕殜闁稿鎹囬弻娑㈠Χ閸涱垍褔鏌$仦鍓ф创濠碉紕鍏橀、娆撴偂鎼存ɑ瀚介梻鍌欐祰濡椼劎绮堟担璇ユ椽顢橀姀鐘烘憰闂佸搫娴勭槐鏇㈡偪閳ь剟姊洪崫鍕窛闁稿⿴鍋婃俊鐑芥晜鏉炴壆鐩庨梻浣瑰濡線顢氳閳诲秴顓兼径瀣幍濡炪倖姊婚悺鏂库枔濠婂應鍋撶憴鍕妞ゃ劌妫楅銉╁礋椤掑倻鐦堟繛杈剧到婢瑰﹤螞濠婂牊鈷掗柛灞捐壘閳ь剟顥撶划鍫熺瑹閳ь剟鐛径鎰伋閻℃帊鐒﹀浠嬪极閸愵喖纾兼慨妯诲敾缁卞崬鈹戦悩顔肩伇闁糕晜鐗犲畷婵嬪即閵忕姴寮烽梺闈涱槴閺呮粓鎮¢悢鍏肩厵闂侇叏绠戦弸娑㈡煕閺傛鍎旈柡灞界Ч閺屻劎鈧綆浜炴导宀勬⒑鐠団€虫灈缂傚秴锕悰顔界瑹閳ь剟鐛幒妤€绠f繝鍨姉閳ь剝娅曠换婵嬫偨闂堟稐绮堕梺鐟板暱缁绘ê鐣峰┑鍡忔瀻闁规儳鐤囬幗鏇㈡⒑缂佹ɑ鈷掗柛妯犲懐鐭嗛柛鏇ㄥ灡閻撳繘鏌涢锝囩畺妞ゃ儲绮嶉妵鍕疀閵夛箑顏�



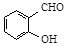 )和對羥基苯甲醛(
)和對羥基苯甲醛(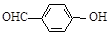 )的沸點
)的沸點