【題目】I.已知在常溫常壓下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) △H=-1275.6kJ·mol-1
②H2O(l)=H2O(g) △H=+44.0kJ·mol-1
寫出表示甲醇燃燒熱的熱化學(xué)方程式 。
II.甲醇可以與水蒸氣反應(yīng)生成氫氣,反應(yīng)方程式如下:
CH3OH(g)+H2O(g) CO2(g)+3H2(g) △H>0
CO2(g)+3H2(g) △H>0
(1)一定條件下,向體積為2L的恒容密閉容器中充入1molCH3OH(g)和3molH2O(g),20s后�,測(cè)得混合氣體的壓強(qiáng)是反映前的1.2倍�����,則用甲醇表示該反應(yīng)的速率為 。
(2)判斷(1)中可逆反應(yīng)達(dá)到平衡狀態(tài)的依據(jù)是(填序號(hào)) ��。
① v正(CH3OH)=3v逆(H2)
混合氣體的密度不變
混合氣體的平均相對(duì)分子質(zhì)量不變
④CH3OH�����、H2O、CO2����、H2的濃度都不再發(fā)生變化
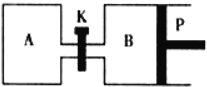
(3)右圖中P是可自由平行滑動(dòng)的活塞��,關(guān)閉K,在相同溫度時(shí)�,向A容器中充入1molCH3OH(g)和2molH2O(g),向B容器中充入1.2molCH3OH(g)和2.4molH2O(g)���,兩容器分別發(fā)生上述反應(yīng)����。已知起始時(shí)容器A和B的體積均為aL,反應(yīng)達(dá)到平衡時(shí)容器B的體積為1.5aL����,容器B中CH3OH轉(zhuǎn)化率為 �;維持其他條件不變,若打開K一段時(shí)間后重新達(dá)到平衡����,容器B的體積為 L(連通管中氣體體積忽略不計(jì),且不考慮溫度的影響)�。