
科目: 來(lái)源: 題型:解答題
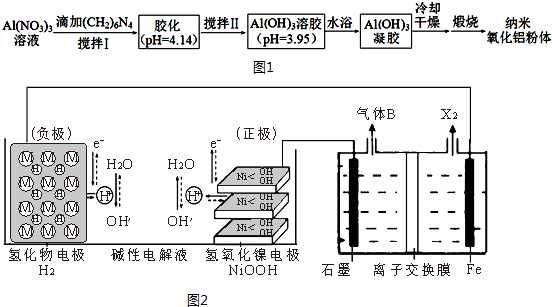
 .
.
查看答案和解析>>
科目: 來(lái)源: 題型:解答題
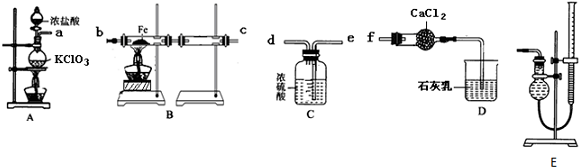
查看答案和解析>>
科目: 來(lái)源: 題型:解答題
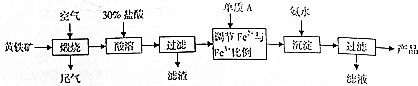
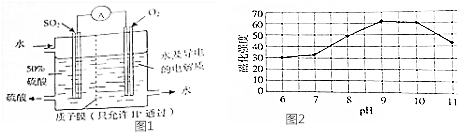
| 溫度/℃ | 產(chǎn)品顏色 |
| 35 | 灰色 |
| 40 | 灰黑 |
| 60 | 黑色 |
| 65 | 紅黑 |
| 80 | 黑褐 |
查看答案和解析>>
科目: 來(lái)源: 題型:解答題
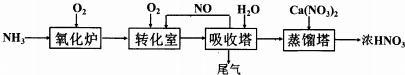
查看答案和解析>>
科目: 來(lái)源: 題型:解答題
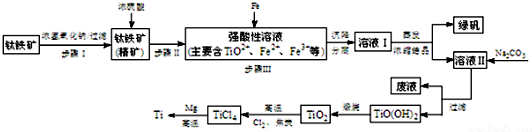
| pH | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Ti(OH)2 |
| 開(kāi)始沉淀 | 1.1 | 4.5 | 7 | 1 |
| 完全沉淀 | 2.8 | 6.4 | 9.2 | 2.7 |
| TiCl4 | Mg | MgCl2 | Ti | |
| 熔點(diǎn)/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸點(diǎn)/℃ | 136.4 | 1090 | 1412 | 3287 |
查看答案和解析>>
科目: 來(lái)源: 題型:解答題
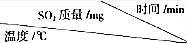 | 0 | 20 | 40 | 60 | 80 | 100 | 120 |
| T1 | 2100 | 1052 | 540 | 199 | 8.7 | 0.06 | 0.06 |
| T2 | 2100 | 869 | 242 | x | x | x | x |
查看答案和解析>>
科目: 來(lái)源: 題型:解答題
查看答案和解析>>
科目: 來(lái)源: 題型:解答題
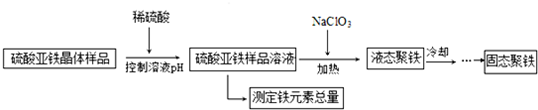
查看答案和解析>>
科目: 來(lái)源: 題型:解答題
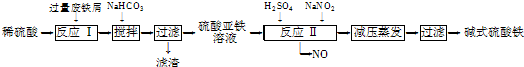
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 開(kāi)始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
科目: 來(lái)源: 題型:解答題
| 第一次滴定 | 第二次滴定 | 第三次滴定 | |
| 待測(cè)溶液體積(mL) | 25.00 | 25.00 | 25.00 |
| 標(biāo)準(zhǔn)溶液體積(mL) | 9.99 | 10.01 | 10.00 |
查看答案和解析>>
百度致信 - 練習(xí)冊(cè)列表 - 試題列表
湖北省互聯(lián)網(wǎng)違法和不良信息舉報(bào)平臺(tái) | 網(wǎng)上有害信息舉報(bào)專(zhuān)區(qū) | 電信詐騙舉報(bào)專(zhuān)區(qū) | 涉歷史虛無(wú)主義有害信息舉報(bào)專(zhuān)區(qū) | 涉企侵權(quán)舉報(bào)專(zhuān)區(qū)
違法和不良信息舉報(bào)電話:027-86699610 舉報(bào)郵箱:58377363@163.com