
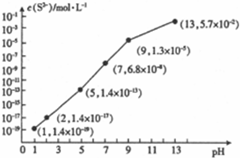
��Ŀ�� ��(l��i)Դ�� �}�ͣ�����}

| �������� | Fe��OH��3 | Fe��OH��2 | Cu��OH��2 | Zn��OH��2 |
| �_(k��i)ʼ����r(sh��)��pH | 1.9 | 6.5 | 4.2 | 5.4 |
| ��ȫ����r(sh��)��pH | 3.3 | 9.7 | 6.7 | 8.2 |
�鿴�𰸺ͽ���>>
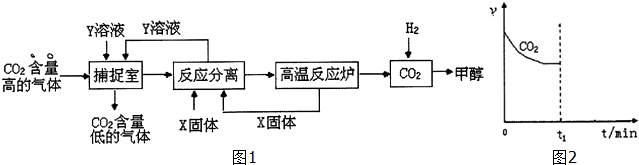
��Ŀ�� ��(l��i)Դ�� �}�ͣ�����}
 | 15 | 25 | 35 |
| 0 | 0 | 0 | 0 |
| t1 | 0.9��10-3 | 2.7��10-3 | 8.1��10-3 |
| t2 | 2.4��10-3 | 4.8��10-3 | 9.4��10-3 |
| t3 | 2.4��10-3 | 4.8��10-3 | 9.4��10-3 |
�鿴�𰸺ͽ���>>
��Ŀ�� ��(l��i)Դ�� �}�ͣ�����}
 H2PO4-+H+��
H2PO4-+H+��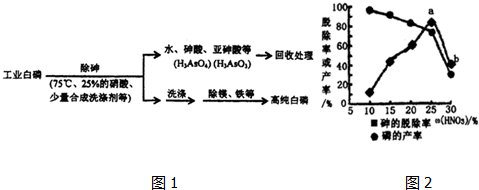
�鿴�𰸺ͽ���>>
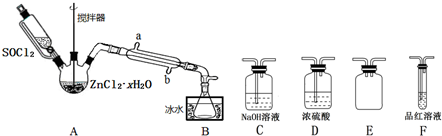
��Ŀ�� ��(l��i)Դ�� �}�ͣ�����}
�鿴�𰸺ͽ���>>
��Ŀ�� ��(l��i)Դ�� �}�ͣ�����}
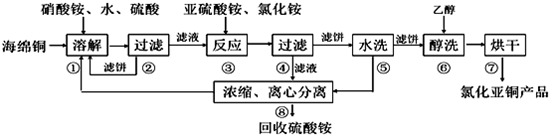
�鿴�𰸺ͽ���>>
��Ŀ�� ��(l��i)Դ�� �}�ͣ���(sh��)�(y��n)�}
 ��D��ʾ��(sh��)�(y��n)�b�ÿ�������ȡ��Ȳ��
��D��ʾ��(sh��)�(y��n)�b�ÿ�������ȡ��Ȳ���鿴�𰸺ͽ���>>
��Ŀ�� ��(l��i)Դ�� �}�ͣ�����}
| �ζ��Δ�(sh��) | ���y(c��)Һ�w�e��mL�� | ��(bi��o)��(zh��n)�}���w�e��mL�� | |
| �ζ�ǰ�x��(sh��)��mL�� | �ζ����x��(sh��)��mL�� | ||
| ��һ�� | 10.00 | 0.50 | 20.40 |
| �ڶ��� | 10.00 | 4.00 | 24.10 |
�鿴�𰸺ͽ���>>
��Ŀ�� ��(l��i)Դ�� �}�ͣ��x���}
| A�� | ��Һ��pH | B�� | ��Һ�Č�(d��o)����� | ||
| C�� | �������xƽ�ⳣ��(sh��) | D�� | �����c ��OH-�� |
�鿴�𰸺ͽ���>>
��Ŀ�� ��(l��i)Դ�� �}�ͣ�����}
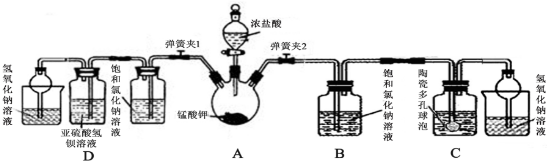
�鿴�𰸺ͽ���>>
��Ŀ�� ��(l��i)Դ�� �}�ͣ�����}
 ij��(sh��)�(y��n)С�M�ÏU�Fм��������S��Ԫ�أ���ԭ���Ƃ���������F������⛾��w[K3Fe��C2O4��3•3H2O]���y(c��)����M�ɣ�
ij��(sh��)�(y��n)С�M�ÏU�Fм��������S��Ԫ�أ���ԭ���Ƃ���������F������⛾��w[K3Fe��C2O4��3•3H2O]���y(c��)����M�ɣ�
�鿴�𰸺ͽ���>>
�ٶ����� - ����(x��)��(c��)�б� - ԇ�}�б�
����ʡ��(li��n)�W(w��ng)�`���Ͳ�����Ϣ�e��(b��o)ƽ�_(t��i) | �W(w��ng)���к���Ϣ�e��(b��o)���^(q��) | ����p�_�e��(b��o)���^(q��) | ��vʷ̓�o(w��)���x�к���Ϣ�e��(b��o)���^(q��) | �����֙�(qu��n)�e��(b��o)���^(q��)
�`���Ͳ�����Ϣ�e��(b��o)�Ԓ��027-86699610 �e��(b��o)�]�䣺58377363@163.com