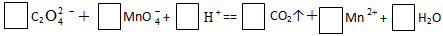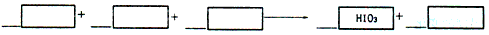���P(gu��n)��(x��)�}
0 7454 7462 7468 7472 7478 7480 7484 7490 7492 7498 7504 7508 7510 7514 7520 7522 7528 7532 7534 7538 7540 7544 7546 7548 7549 7550 7552 7553 7554 7556 7558 7562 7564 7568 7570 7574 7580 7582 7588 7592 7594 7598 7604 7610 7612 7618 7622 7624 7630 7634 7640 7648 203614
��Ŀ��
��(l��i)Դ�����߿����}
�}�ͣ�����}
��1����ƽ����߀ԭ����(y��ng)����ʽ
��2���Q(ch��ng)ȡ6.0g��H2C2O4��2H2O�����KHC2O4��K2SO4��ԇ���������ˮ�ܽ����������250mL ��Һ��������ȡ�ɷݴ���Һ��25mL�����քe���ڃɂ�(g��)�F��ƿ�������
�ٵ�һ����Һ�м���2�η�̪ԇҺ�������μ�0.25 mol/L NaOH ��Һ��20mL�r(sh��)�����Һ�ɟo(w��)ɫ׃?y��u)�\�tɫ��ԓ��Һ���к͵�H+�����|(zh��)������_(k��i)_________mol�������
�ڵڶ�����Һ�μ�0.10 mol/L ����KMnO4��Һ��16mL�r(sh��)����(y��ng)��ȫ������˕r(sh��)��Һ�ɫ����__________׃?y��u)?BR>___________����ԓ��Һ��߀ԭ�������|(zh��)����________mol�����
��ԭԇ����H2C2O4��2H2O���|(zh��)����?j��n)?sh��)��_(k��i)________����KHC2O4���|(zh��)����?j��n)?sh��)��_(k��i)__________������
�鿴�𰸺ͽ���>>
��Ŀ��
��(l��i)Դ�����߿����}
�}�ͣ�����}
2g Cu2S��CuS�Ļ������������Һ����400mL 0.075mol/L KMnO4��Һ̎�����l(f��)������(y��ng)���£�
8MnO4-��5Cu2S��44H+��10Cu2+��5SO2��8Mn2+��22H2O
6MnO4-��5CuS��28H+��5Cu2+��5SO2��6Mn2+��14H2O
����(y��ng)�������Һ�������s�MSO2��ʣ���KMnO4ǡ���c350mL 0.1mol/L(NH4)2Fe(SO4)2��Һ��ȫ����(y��ng)�������
��1����ƽKMnO4�c(NH4)2Fe(SO4)2����(y��ng)���x�ӷ���ʽ��
___MnO4-��___Fe2+��____H+��_____Mn2+��____Fe3+��_____H2O
��2��KMnO4��Һ�c����ﷴ��(y��ng)���������ʣ��KMnO4�����|(zh��)������_(k��i)_______mol�����
��3��������500mL 0.1mol/L Fe2+��Һ������Q(ch��ng)ȡ(NH4)2Fe(SO4)2��6H2O��M��392g/mol�����|(zh��)����_(k��i)___g������
��4���������Cu2S���|(zh��)����?j��n)?sh��)��_(k��i)_______��
�鿴�𰸺ͽ���>>
��Ŀ��
��(l��i)Դ������ʡģ�M�}
�}�ͣ����x�}
FeS�cһ����ȵ�HNO3����(y��ng)��������Fe(NO3)3���Fe2(SO4)3��NO2�����N2O4����NO��H2O�������(d��ng)NO2��N2O4�����NO�����|(zh��)����֮�Ȟ�4:1:4�r(sh��)��������(sh��)�H���ӷ���(y��ng)��FeS�cHNO3�����|(zh��)����֮�Ȟ�
A.1:6
B.2:15
C.2:3
D.16:25
�鿴�𰸺ͽ���>>
��Ŀ��
��(l��i)Դ���Ϻ�ģ�M�}
�}�ͣ�����}
ijһ����(y��ng)�wϵ��������5�N���|(zh��)��HCl�����KCl�����Cl2��KClO3��X��������֪X��ԓ����(y��ng)��������֮һ������
(1)X�Ļ��W(xu��)ʽ��___________��
(2)���@5�N���|(zh��)�M��һ��(g��)�����Ļ��W(xu��)����ʽ��______________�����
(3)��ԓ����(y��ng)���������ӵ����|(zh��)��____�����������Ԫ����____��ÿ����3 mol X��������D(zhu��n)����Ӕ�(sh��)��_(k��i)______����
(4)���ЃɷNͬλ��35Cl�����37Cl��������֪��������(y��ng)�wϵ��KCl��KClO3����HCl��ֻ��һ�N�ȵ�ͬλ��������Cl2��ƽ������(du��)�����|(zh��)����73.3���t��Cl2��߀����35Cl�����|(zh��)��___________����
�鿴�𰸺ͽ���>>
��Ŀ��
��(l��i)Դ��ͬ���}
�}�ͣ�����}
��ʢ��KI��Һ��ԇ���м������SCCl4��μ����Ƶ���ˮ������CCl4��׃����ɫ������^�m(x��)��ԇ���еμ���ˮ������ʎ�����CCl4�ӕ�(hu��)��u׃�\�������׃�ɟo(w��)ɫ��������������գ�
��1����(xi��)������ƽCCl4������ɫ׃�ɟo(w��)ɫ�Ļ��W(xu��)����(y��ng)����ʽ�����ϵ��(sh��)��1�������(xi��)����
��2����KI�Q��KBr�������tCCl4��׃?y��u)�_(k��i)________ɫ����^�m(x��)�μ���ˮ���CCl4�ӵ��ɫ�](m��i)��׃�����tCl2������
HIO3������HBrO3���������ɏ�(qi��ng)�����������____________________��
�鿴�𰸺ͽ���>>
��Ŀ��
��(l��i)Դ�������߿����}
�}�ͣ�����}
(1)���^�⏊(qi��ng)�A��Һ����ɫ(MnO4-)�D(zhu��n)׃?y��u)�Gɫ��MnO42-�������Ո(q��ng)������з���(y��ng)����ʽ��
4MnO4-+___OH-��4MnO42-+____+____������
������MnO42-�D(zhu��n)׃?y��u)�MnO4-�ăɷN��������Ո(q��ng)�������(y��ng)�ķ���ʽ����
(2)ͨ��CO2���͏�(qi��ng)�A�ĝ�ȣ�3MnO42-+____ H2O��____MnO4-+____MnO2+____ OH-
(3)늽������
���(y��ng)�O����(y��ng)ʽ��____________����ꎘO����(y��ng)ʽ��________________������
�ڌ�(sh��)�(y��n)�аl(f��)�F(xi��n)����늽�r(sh��)�g�^(gu��)�L(zh��ng)���������Һ�ɫ���D(zhu��n)׃�ɾGɫ��������ʲô��______________������
�鿴�𰸺ͽ���>>
��Ŀ��
��(l��i)Դ����(zhu��n)�(xi��ng)�}
�}�ͣ�����}
�S�����ϿƌW(xu��)�İl(f��)չ�������C���仯����õ���Խ��(l��i)Խ�V���đ�(y��ng)�����������u(y��)�顰�Ͻ�ľS���ء������CԪ�؏V����ɢ�ڸ��N�V���������C♵V����Ҫ�ɷֿ��û��W(xu��)ʽ��ʾ��K2H6U2V2O15���y(c��)�������CԪ�غ����ķ����ǣ��ȰѵVʯ�е��CԪ���D(zhu��n)����V2O5���CԪ�صĻ��σr(ji��)��׃���������V2O5��������Һ���D(zhu��n)����VO2+���������ò���Ȝy(c��)���C��������������(y��ng)�ɱ�ʾ�飺VO2++ H2C2O4+H+��VO2++CO2+H2O
��Ո(q��ng)����������(y��ng)��ƽ���
�ƬF(xi��n)����C♵V��Ʒ10.2g��������������(l��i)�y(c��)���C�ĺ�����������Y(ji��)������0.9g�����������ô����C♵V���CԪ�ص��|(zh��)����?j��n)?sh��)��________���������������ʽ��ʾ��C♵V����Ҫ�ɷ������仯�W(xu��)ʽ��_(k��i)________���
�鿴�𰸺ͽ���>>
��Ŀ��
��(l��i)Դ����(zhu��n)�(xi��ng)�}
�}�ͣ������(xi��ng)�x���}
��һ���l���£�RO3n-�c����ɰl(f��)�����·���(y��ng)��RO3n- + F2 + 2OH- = RO4- + 2F- + H2O �Ķ���֪��RO3n-�������Ԫ��R�Ļ��σr(ji��)��
A�����+4
B���+5
C������+6
D��+7
�鿴�𰸺ͽ���>>
��Ŀ��
��(l��i)Դ��ͬ���}
�}�ͣ�����}
����߀ԭ����(y��ng)�Ќ�(sh��)�H�ϰ���������߀ԭ�ɂ�(g��)�^(gu��)�����������һ��(g��)߀ԭ�^(gu��)�̵ķ���(y��ng)ʽ��
NO3-+4H++3e-= NO��+2H2O��KMnO4������Na2CO3��Cu2O�����Fe2(SO4)3�ķN���|(zh��)�е�һ�N���|(zh��)��ʹ����߀ԭ�^(gu��)�̰l(f��)������
(1)��(xi��)������ƽԓ����߀ԭ����(y��ng)�ķ���ʽ��_____________________���
(2)����(y��ng)�������w�F(xi��n)��___________���___________����W(xu��)���|(zh��)����
(3)����(y��ng)�����a(ch��n)����0.2 mol���w�����t�D(zhu��n)����ӵ����|(zh��)������________mol������
�鿴�𰸺ͽ���>>
��Ŀ��
��(l��i)Դ��ģ�M�}
�}�ͣ�����}
��X��Y�ɷNԪ�������ڱ���λ��ͬһ���������������һ�N�������Ԫ�أ��҃������һ��(g��)������������m=n>0�������һ���l���������з���(y��ng)��δ��ƽ����Xm +Yn+H2O��HXO3+HY���Ո(q��ng)�ش����І�(w��n)�}��
(1)ԓ����(y��ng)��߀ԭ�������ʽ��_(k��i)_____________����
(2)��ƽ�������W(xu��)����ʽ��_________________���û��W(xu��)ʽ��ʾ������
(3)��ij���W(xu��)����(y��ng)���£�KX +Yn+H2O��KXO3+Xm+HY+KY��δ��ƽ��������KXO3��Xm�Ļ��W(xu��)Ӌ(j��)����(sh��)����1�����tYn�Ļ��W(xu��)Ӌ(j��)����(sh��)��_(k��i)_________��������(bi��o)������D(zhu��n)�Ƶķ���͔�(sh��)Ŀ��KX+Yn+H2O�� ______________
(4)��֪���ڷ���(y��ng)����������������(y��ng)��߀ԭ����(y��ng)�l(f��)����ͬһ������̎��ͬһ���σr(ji��)��ͬ�NԪ��������ʹԓԪ�ص�ԭ�ӣ����x�ӣ�һ���ֱ������������һ���ֱ�߀ԭ����@�N����������߀ԭ����(y��ng)�Q(ch��ng)���绯����(y��ng)����(sh��)�(y��n)��ģ�MKXO3���Ʒ�����
�����M(j��n)�в��EI�Č�(sh��)�(y��n)�r(sh��)������ЌW(xu��)������늽��b����U��������еČW(xu��)�������ß��������J(r��n)�����ķN�x�������m_________�������Q(ch��ng)�������
�ڲ��EI��ꎘO늘O����(y��ng)ʽ��_(k��i)____________________ ���û��W(xu��)ʽ��ʾ�����
�۲��EI����NaYO�绯����NaYO3���x�ӷ���ʽ��_(k��i)_________________���û��W(xu��)ʽ��ʾ�������
�ܲ��E������NaYO3��Һ�м����ĩ���KY���������������KYO3�����2 L 3 mol/L��NaYO3��Һ�У�������Ҫ����_______mol KY��ĩ�Ɍ���Һ�е�YO3-���������׃?y��u)?.1 mol/L[��֪Ksp(KYO3)=0.366���Ӌ(j��)��Y(ji��) �������λС��(sh��)������KY��ĩ����Һ�w�e��׃]�������
�鿴�𰸺ͽ���>>