在一體積為10 L的容器中�����,通人一定量的CO和H2O��,在850℃時(shí)發(fā)生如下反應(yīng):CO(g)十H2O(g) CO2(g)十H2(g) ΔH<0����,且K=1.
CO2(g)十H2(g) ΔH<0����,且K=1.
(1)850℃時(shí),若向一容積可變的密閉容器中同時(shí)充入1.0 mol CO�,3.0 mol H2O,1.0 mol CO2和x mol H2����,則:
①當(dāng)x=5.0時(shí),上述平衡向________(填“正反應(yīng)”或“逆反應(yīng)”)方向移動(dòng).
②若要使上述反應(yīng)開始時(shí)向正反應(yīng)方向進(jìn)行��,則x應(yīng)滿足的條件是________.
③若設(shè)x=5.0和x=6.0�,其他物質(zhì)的投料不變,當(dāng)上述反應(yīng)達(dá)到平衡后�,測得H2的體積分?jǐn)?shù)分別為a%、b%�,則a________b(填“大于”“小于”或“等于”).
④CO和H2O濃度變化如下圖,則0-4 min的平均反應(yīng)速率v(CO)=________ mol/(L·min)
(2)若升高溫度到950℃時(shí)�,達(dá)到平衡時(shí)K________1(填“大于”“小于”或“等于”).
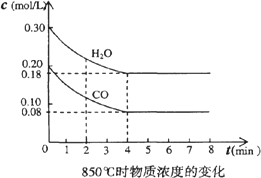
(3)t1℃(高于850℃)時(shí),在相同容器中發(fā)生上述反應(yīng)��,容器內(nèi)各物質(zhì)的濃度變化如下表.
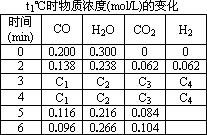
①表中3 min-4 min之間反應(yīng)處于________狀態(tài)��;
C1數(shù)值________0.08 mol/L(填大于、小于或等于).
②反應(yīng)在4 min-5 min問����,平衡向逆方向移動(dòng),可能的原因是________(單選)����,表中5 min-6 min之間數(shù)值發(fā)生變化�,可能的原因是________(單選).
a.增加水蒸氣
b.降低溫度
c.使用催化劑
d.增加氫氣濃度
(4)下列敘述中說明反應(yīng)2HI(g) H2(g)+I(xiàn)2(g)已達(dá)到平衡的是________
H2(g)+I(xiàn)2(g)已達(dá)到平衡的是________
①單位時(shí)間內(nèi)生成n mol H2的同時(shí)生成n mol HI
②一個(gè)H-H鍵斷裂的同時(shí)有兩個(gè)H-I鍵斷裂
③c(HI)∶c(H2)∶c(I2)=2∶1∶1時(shí)
④溫度和體積一定時(shí),容器內(nèi)壓強(qiáng)不再變化
⑤溫度和壓強(qiáng)一定時(shí)��,混合氣體的密度不再變化
⑥溫度和體積一定時(shí)��,混合氣體的顏色不再變化
⑦條件一定��,混合氣體的平均相對分子質(zhì)量不再變化
