
Ь}─┐┴л▒ь(░Ч└е┤░И║═йР╬Ш)
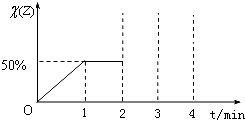
їбH2S║═O2х─╗В║¤џРзw, н┌120АТЋr(shеф)Лb╚вм╗├▄ж]╚Пкэол, И▀юп¤┬╩╣о«и┤Љф(yеЕng), мЛофH2S ║═O2╚Ф▓┐Х╝Ёб╝М┴╦и┤Љф(yеЕng). и┤Љф(yеЕng)║з, їбюпХ╚╗оЈ═(fе┤)хй120АТ, юyх├Ѕ║Јі(qiебng)ъжи┤Љф(yеЕng)К░х─3/4▒Х, ёtнГ╗В║¤џРзwолH2S║═O2х─╬№┘|(zhег)х─┴┐о«▒╚╩К
[АААА]
A.2А├1ААААB.1А├2ААААC.1А├1ААААD.1А├3
░┘Х╚о┬л┼ - Йџ┴Ћ(xеф)Ѓн┴л▒ь - нЄЬ}┴л▒ь
║■▒▒╩А╗Ц┬Њ(liебn)ЙW(wеБng)▀`ие║═▓╗┴╝л┼¤б┼eѕз(bецo)кй┼_ | ЙW(wеБng)╔¤Мл║дл┼¤б┼eѕз(bецo)їБЁ^(qе▒) | віл┼нpЫ_┼eѕз(bецo)їБЁ^(qе▒) | ╔Тџv╩и╠ЊЪoоэ┴xМл║дл┼¤б┼eѕз(bецo)їБЁ^(qе▒) | ╔ТкзКоЎЯ(quебn)┼eѕз(bецo)їБЁ^(qе▒)
▀`ие║═▓╗┴╝л┼¤б┼eѕз(bецo)вінњБ║027-86699610 ┼eѕз(bецo)Я]¤СБ║58377363@163.com