
題目列表(包括答案和解析)
| 族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | (11) | (12) |


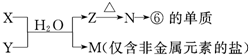
| 編號 | 性質(zhì) | 化學(xué)方程式 |
| 示例 | 氧化性 | H2WO3+3H3PO3═3H3PO4+H2W↑ |
| 1 | 還原性 還原性 |
H2SO3+Br2+2H2O=H2SO3+2HBr H2SO3+Br2+2H2O=H2SO3+2HBr |
| 2 | 酸性 酸性 |
H2SO3+2NaOH=Na2SO3+2H2O H2SO3+2NaOH=Na2SO3+2H2O |
| ||
| 冰晶石 |
| ||
| 冰晶石 |



 或
或
 或
或

 4Al+3O2↑
4Al+3O2↑ 4Al+3O2↑
4Al+3O2↑| 族 周期 |
IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||


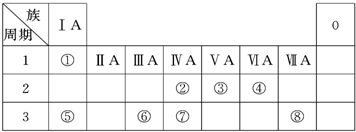
| 族 周期 |
ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | ⑨ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ |




湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權(quán)舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com