
題目列表(包括答案和解析)


| 物質(zhì) | CaCO3 | MgCO3 | Ca(OH)2 | Mg(OH)2 | Fe (OH)3 |
| Ksp | 4.96×10-9 | 6.82×10-6 | 4.68×10-6 | 5.61×10-12 | 2.64×10-39 |
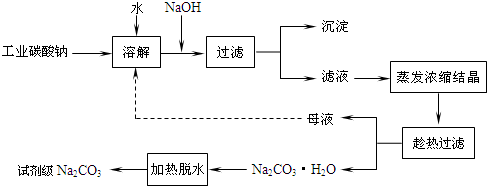
| 實驗 編號 |
KClO3 (g) |
氧化物 | 產(chǎn)生氣體(mL) (已折算為標況) |
耗時(s) | ||
| 化學(xué)式 | 質(zhì)量(g) | 回收 | ||||
| 1 | 0.6 | - | - | - | 10 | 480 |
| 2 | 0.6 | MnO2 | 0.20 | 90% | 67.2 | 36.5 |
| 3 | 0.6 | CuO | 0.20 | 90% | 67.2 | 79.5 |
| 4 | 0.6 | Fe2O3 | 0.20 | 90% | 67.2 | 34.7 |
| 5 | 0.6 | Cr2O3 | 0.20 | 異常 | 67.2 | 188.3 |
| 實驗次數(shù)編號 | 待測液體積mL | 滴入的標準液體積(mL) |
| 1 | 25.00 | 28.95 |
| 2 | 25.00 | 25.05 |
| 3 | 25.00 | 24.95 |
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權(quán)舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com