【答案】-574.4 kJ/mol d 0.064mol/(L·min) 625 CH3OH+8OH–-6e–=CO32-+6H2O 5CH3OH+6ClO2=6Cl-+5CO2+6H++7H2O
【解析】
(1)結(jié)合熱化學(xué)方程式和蓋斯定律計(jì)算���,計(jì)算①+②×2-③得到CO(g)+2H2(g) CH3OH(g)的熱化學(xué)方程式;
CH3OH(g)的熱化學(xué)方程式;
(2)a.圖1表示t1時(shí)刻如果達(dá)平衡�,正反應(yīng)速率不變;
b.平衡常數(shù)不變�,說(shuō)明體系的溫度不變,而在絕熱的體系中�����;
c.一氧化碳與甲醇的物質(zhì)的量相等�;
d.一氧化碳的質(zhì)量分?jǐn)?shù)不變,說(shuō)明各物質(zhì)的質(zhì)量不變��,反應(yīng)達(dá)平衡狀態(tài)�����;
(3)根據(jù)反應(yīng)速率為v(H2)=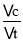 ,氣體物質(zhì)的量之比等于氣體體積之比����,平衡常數(shù)隨溫度變化,K=
,氣體物質(zhì)的量之比等于氣體體積之比����,平衡常數(shù)隨溫度變化,K=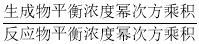 ����;
����;
(4)燃料原電池中,燃料失電子發(fā)生氧化反應(yīng)為負(fù)極�,通入氧氣得到電子發(fā)生還原反應(yīng)為正極,電解池中陰極被保護(hù)����;
(5)根據(jù)信息:二氧化氯和甲醇反應(yīng),生成Cl-���、CO2和水�,配平方程式即可���。
(1)①CO(g)+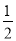 O2(g)=CO2(g) △H1=-283.0kJ/mol
O2(g)=CO2(g) △H1=-283.0kJ/mol
②H2(g)+ O2(g)=H2O(g) △H2=-241.8kJ/mol
O2(g)=H2O(g) △H2=-241.8kJ/mol
③CH3OH(g)+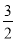 O2(g)=CO2(g)+2H2O(g) △H3=-192.2kJ/mol
O2(g)=CO2(g)+2H2O(g) △H3=-192.2kJ/mol
蓋斯定律計(jì)算①+②×2-③��,整理可得:CO(g)+2H2(g) CH3OH(g) △H4=-574.4kJ/mol���;
CH3OH(g) △H4=-574.4kJ/mol���;
(2)a.圖1表示t1時(shí)刻如果達(dá)平衡�,正反應(yīng)速率不變���,而不是隨時(shí)間間改變而減小���,a錯(cuò)誤;
b.充入1molCO��、2molH2����,生成生成物甲醇���,放出熱量��,反應(yīng)體系的溫度升高�,K減小���,而不是增大��,b錯(cuò)誤�����;
c.一氧化碳與甲醇的物質(zhì)的量相等���,而不是平衡狀態(tài)���,c錯(cuò)誤;
d.隨著反應(yīng)的進(jìn)行����,一氧化碳的質(zhì)量減小,一氧化碳的質(zhì)量分?jǐn)?shù)不變�����,說(shuō)明各物質(zhì)的質(zhì)量不變����,反應(yīng)達(dá)平衡狀態(tài),d正確��;
故合理選項(xiàng)是d�����;
(3)T1℃時(shí),在一個(gè)體積為5L的恒容容器中充入1mol CO�、2mol H2,經(jīng)過(guò)5min達(dá)到平衡��,CO的轉(zhuǎn)化率為0.8��,則反應(yīng)的CO的物質(zhì)的量為0.8mol��,根據(jù)方程式中物質(zhì)轉(zhuǎn)化關(guān)系可知����,反應(yīng)消耗1.6molH2,同時(shí)生成CH3OH的物質(zhì)的量為0.8mol����,則平衡時(shí)CO的物質(zhì)的量為0.2mol�,H2為0.4mol,CH3OH為0.8mol�����,由于容器的容積為5L���,則平衡時(shí)�,各種物質(zhì)的濃度c(CO)= 0.04mol/L,c(H2)=0.08mol/L���,c(CH3OH)=0.16mol/L���。則5min內(nèi)用H2表示的反應(yīng)速率為v(H2)=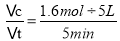 =0.064mol/(L·min);
=0.064mol/(L·min);
T1℃時(shí)��,CO(g)+2H2(g) CH3OH(g)的平衡常數(shù)K=
CH3OH(g)的平衡常數(shù)K=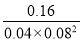 =625����;
=625����;
(4)在甲醇燃料原電池中,甲醇失電子發(fā)生氧化反應(yīng)��,所以通入燃料甲醇的電極為負(fù)極����,電極反應(yīng)式為:CH3OH+8OH--6e-=CO32-+6H2O;
(5)根據(jù)信息:二氧化氯和甲醇反應(yīng)����,生成Cl-、CO2和水�,所以反應(yīng)方程式為:6ClO2+5CH3OH=6Cl-+5CO2+6H++7H2O。