
科目: 來源: 題型:
查看答案和解析>>
科目: 來源: 題型:

查看答案和解析>>
科目: 來源: 題型:
查看答案和解析>>
科目: 來源: 題型:
| ① | |||||||||||||||||
| ④ | ⑤ | ⑥ | |||||||||||||||
| ② | ③ | ⑦ | |||||||||||||||
| Fe | |||||||||||||||||
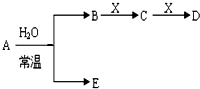

查看答案和解析>>
科目: 來源: 題型:
查看答案和解析>>
科目: 來源: 題型:
查看答案和解析>>
科目: 來源: 題型:
查看答案和解析>>
科目: 來源: 題型:
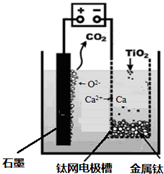 工業(yè)上利用CO和水蒸氣在一定條件下發(fā)生反應(yīng)制取氫氣:
工業(yè)上利用CO和水蒸氣在一定條件下發(fā)生反應(yīng)制取氫氣:| 容器編號 | 起始時各物質(zhì)物質(zhì)的量/mol | 達到平衡的時間/min | 達平衡時體系能量的變化/kJ | ||||
| CO | H2O | CO2 | H2 | ||||
| ① | 1 | 4 | 0 | 0 | t1 | 放出熱量:32.8 kJ | |
| ② | 2 | 8 | 0 | 0 | t2 | 放出熱量:Q | |
| 4 |
| Vt1 |
查看答案和解析>>
科目: 來源: 題型:
| ||
| ||
| 點燃 |
| 乙烷 | 丙烷 | 丁烷 | |
| 熔點/℃ | -183.8 | -189.7 | -138.4 |
| 沸點/℃ | -88.6 | -42.1 | -0.5 |
查看答案和解析>>
科目: 來源: 題型:
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權(quán)舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com