
科目: 來源: 題型:

查看答案和解析>>
科目: 來源: 題型:
| 時間(min) | 0 | 15 | 30 | 45 | 60 | 90 | 120 | |
| 濾紙 條的 顏色 變化 | 玻璃片I上的濾紙條 | 白色 | 白色 | 灰色 | 淺藍色 | 藍色 | 藍色 | 淺藍色 |
| 玻璃片II上的濾紙條 | 白色 | 白色 | 白色 | 白色 | 灰色 | 灰色 | 淺藍色 | |
查看答案和解析>>
科目: 來源: 題型:

查看答案和解析>>
科目: 來源: 題型:
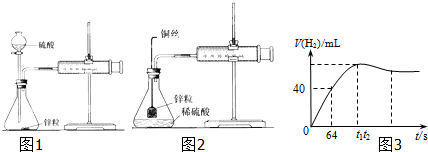
查看答案和解析>>
科目: 來源: 題型:
查看答案和解析>>
科目: 來源: 題型:
| t/℃ | 0 | 10 | 20 | 25 | 40 | 50 | 90 | 100 |
| KW/10-14 | 0.134 | 0.292 | 0.681 | 1.01 | 2.92 | 5.47 | 38.0 | 55.0 |
| 純水 | 加少量鹽酸 | 加少量NaOH | |
| c(H+) | 1.0×10-7 mol/L | 增大 | |
| c(OH-) | 1.0×10-7 mol/L | 增大 | |
| c(H+)和c(OH-)大小比較 | c(H+)=c(OH-) | c(H+) | c(H+) |
| 水的電離平衡移動方向 | |||
| KW值 | 1.0×10-14 |
查看答案和解析>>
科目: 來源: 題型:

查看答案和解析>>
科目: 來源: 題型:

查看答案和解析>>
科目: 來源: 題型:
| 3 |
| 4 |
查看答案和解析>>
科目: 來源: 題型:
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com