
��Ŀ�� ��(l��i)Դ�� �}�ͣ��x���}
| A�� | �٢ڢ� | B�� | �ڢݢ� | C�� | �ۢ�� | D�� | �ޢ� |
�鿴�𰸺ͽ���>>
��Ŀ�� ��(l��i)Դ�� �}�ͣ��x���}
| A�� | 2.3 g�c��ԭ��׃���x�ӕr(sh��)��ʧȥ����Ӕ�(sh��)��1NA | |
| B�� | 0.2NA��(g��)��������c19.6 g���Ậ����ͬ����ԭ�Ӕ�(sh��) | |
| C�� | 28 g��?d��)�����ԭ�Ӕ?sh��)��NA | |
| D�� | NA��(g��)�������cNA��(g��)����ӵ��|(zh��)���Ȟ�2��1 |
�鿴�𰸺ͽ���>>
��Ŀ�� ��(l��i)Դ�� �}�ͣ�����}
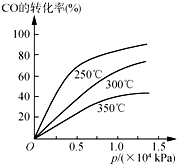 ���I(y��)��һ�������]�����в������з���(y��ng)�ϳɼ״���
���I(y��)��һ�������]�����в������з���(y��ng)�ϳɼ״����鿴�𰸺ͽ���>>
��Ŀ�� ��(l��i)Դ�� �}�ͣ�����}
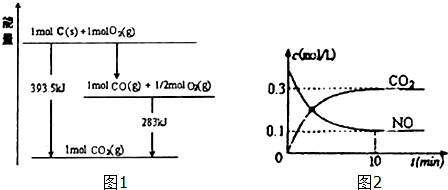
| ��늽��|(zh��) | H2CO3 | NH3•H2O |
| ��xƽ�ⳣ��(sh��) | Ka1=4.2��10-7��������Ka2=5.6��10-11 | 1.7��10-5 |
�鿴�𰸺ͽ���>>
��Ŀ�� ��(l��i)Դ�� �}�ͣ��x���}
| A�� | 51 | B�� | 54 | C�� | 57 | D�� | 60 |
�鿴�𰸺ͽ���>>
��Ŀ�� ��(l��i)Դ�� �}�ͣ��x���}
| A�� | 1��(g��) | B�� | 2��(g��) | C�� | 3��(g��) | D�� | 4��(g��) |
�鿴�𰸺ͽ���>>
��Ŀ�� ��(l��i)Դ�� �}�ͣ��x���}
| A�� | 3�N | B�� | 5�N | C�� | 6�N | D�� | 7�N |
�鿴�𰸺ͽ���>>
��Ŀ�� ��(l��i)Դ�� �}�ͣ�����}
�鿴�𰸺ͽ���>>
��Ŀ�� ��(l��i)Դ�� �}�ͣ�����}
�鿴�𰸺ͽ���>>
��Ŀ�� ��(l��i)Դ�� �}�ͣ�����}
�鿴�𰸺ͽ���>>
�ٶ����� - ����(x��)��(c��)�б� - ԇ�}�б�
����ʡ��(li��n)�W(w��ng)�`���Ͳ�����Ϣ�e��(b��o)ƽ�_(t��i) | �W(w��ng)���к���Ϣ�e��(b��o)���^(q��) | ����p�_�e��(b��o)���^(q��) | ��vʷ̓�o(w��)���x�к���Ϣ�e��(b��o)���^(q��) | �����֙�(qu��n)�e��(b��o)���^(q��)
�`���Ͳ�����Ϣ�e��(b��o)�Ԓ��027-86699610 �e��(b��o)�]�䣺58377363@163.com