
��Ŀ�� ��Դ�� �}�ͣ��x���}
| A�� | CH4+Cl2 $\stackrel{����}{��}$ CH3Cl+HCl | B�� | CH2�TCH2+Br2��CH2BrCH2Br | ||
| C�� | 2CH3CH2OH+O2$��_{��}^{Cu}$2CH3CHO+2H2O | D�� | 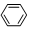 +HNO3$��_{50��60��}^{��H_{2}SO_{4}}$ +HNO3$��_{50��60��}^{��H_{2}SO_{4}}$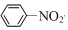 +H2O +H2O |
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ��x���}
| A�� | CO32- | B�� | OH- | C�� | SO42- | D�� | HCO3- |
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�����}
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�����}
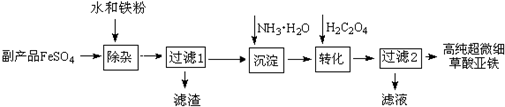
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�����}
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ��x���}
| A�� | ���бP��ƽ�Qȡ35.20g NaOH | |
| B�� | ��10mL��Ͳ��ȡ8.50mL���}����һ�����|(zh��)���������Һ | |
| C�� | ��25ml�ζ�����ȡ15.80ml����Һ��һ�����|(zh��)���������Һ | |
| D�� | ��pHԇ���y����ҺpH��4.2 |
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�����}
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�����}

�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�����}


�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�����}
�鿴�𰸺ͽ���>>
�ٶ����� - ����(x��)���б� - ԇ�}�б�
����ʡ��(li��n)�W(w��ng)�`���Ͳ�����Ϣ�e��ƽ�_ | �W(w��ng)���к���Ϣ�e�^(q��) | ����p�_�e�^(q��) | ��vʷ̓�o���x�к���Ϣ�e�^(q��) | �����֙�(qu��n)�e�^(q��)
�`���Ͳ�����Ϣ�e���Ԓ��027-86699610 �e���]�䣺58377363@163.com