
��Ŀ�� ��(l��i)Դ�� �}�ͣ�����}
| �r(sh��)�g/min | 0 | 10 | 20 | 30 | 40 |
| n��PCl3��/mol | 4 | 2.8 | 2 | 1 | 1 |
�鿴�𰸺ͽ���>>
��Ŀ�� ��(l��i)Դ�� �}�ͣ�����}

�鿴�𰸺ͽ���>>
��Ŀ�� ��(l��i)Դ�� �}�ͣ�����}
�鿴�𰸺ͽ���>>
��Ŀ�� ��(l��i)Դ�� �}�ͣ�����}
�鿴�𰸺ͽ���>>
��Ŀ�� ��(l��i)Դ�� �}�ͣ�����}
| ���(bi��o)��(zh��n) | ���ن��|(zh��) | ������ | ��Һ | �z�w |
| ����ԓ����|(zh��) | �� | ��� |
�鿴�𰸺ͽ���>>
��Ŀ�� ��(l��i)Դ�� �}�ͣ��x���}
| A�� | $\frac{��a+b��}{4}$ mol/L | B�� | 4��3a+b�� mol/L | C�� | 4��a+b�� mol/L | D�� | $\frac{��3a+b��}{4}$mol/L |
�鿴�𰸺ͽ���>>
��Ŀ�� ��(l��i)Դ�� �}�ͣ��x���}
| A�� | 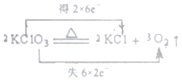 | B�� |  | ||
| C�� | 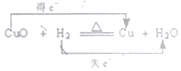 | D�� |  |
�鿴�𰸺ͽ���>>
��Ŀ�� ��(l��i)Դ�� �}�ͣ��x���}
| A�� | �٢� | B�� | �٢ܢ� | C�� | �٢ڢۢ� | D�� | �٢ڢۢܢ� |
�鿴�𰸺ͽ���>>
��Ŀ�� ��(l��i)Դ�� �}�ͣ��x���}
| A�� | Cu2++2OH-�TCu��OH��2�� CuCO3+2NaOH�TCu��OH��2��+Na2CO3 | |
| B�� | CO32-+2H+�TCO2��+H2O BaCO3+2HCl�TBaCl2+CO2��+H2O | |
| C�� | CO32-+Ca2+�TCaCO3�� Ca��NO3��2+NaCO3�TCaCO3��+NaNO3 | |
| D�� | H++OH-�TH2O 2KOH+H2SO4�TK2SO4+2H2O |
�鿴�𰸺ͽ���>>
��Ŀ�� ��(l��i)Դ�� �}�ͣ�����}
�鿴�𰸺ͽ���>>
�ٶ����� - ����(x��)��(c��)�б� - ԇ�}�б�
����ʡ��(li��n)�W(w��ng)�`���Ͳ�����Ϣ�e��(b��o)ƽ�_(t��i) | �W(w��ng)���к���Ϣ�e��(b��o)���^(q��) | ����p�_�e��(b��o)���^(q��) | ��vʷ̓�o(w��)���x�к���Ϣ�e��(b��o)���^(q��) | �����֙�(qu��n)�e��(b��o)���^(q��)
�`���Ͳ�����Ϣ�e��(b��o)�Ԓ��027-86699610 �e��(b��o)�]�䣺58377363@163.com