
��Ŀ�� ��Դ�� �}�ͣ�����}
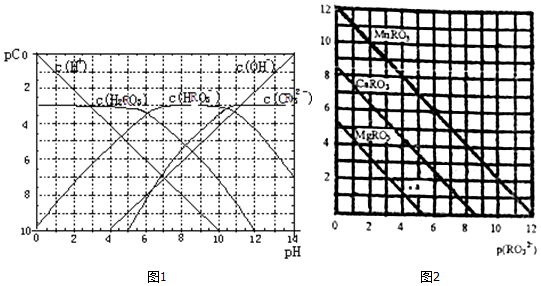
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�����}
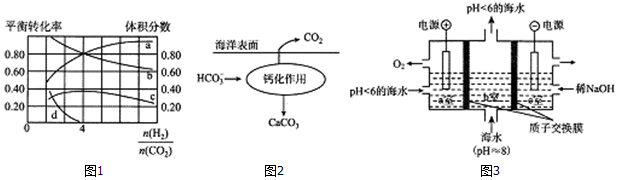
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�����}
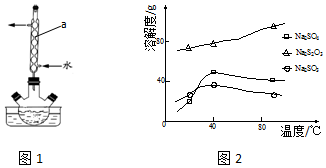
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�����}

 ͬ�֮���(g��u)�w�ĽY(ji��)��(g��u)��ʽ��
ͬ�֮���(g��u)�w�ĽY(ji��)��(g��u)��ʽ��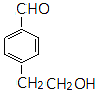 ��
��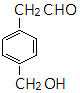 ��
��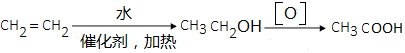 �����o�C(j��)ԇ���������x��
�����o�C(j��)ԇ���������x���鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�����}
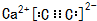 ��
��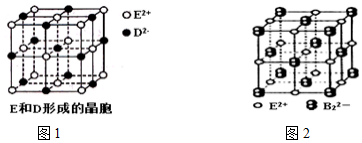
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ����x�}
| A�� | ��һ��x�ܣ��ۣ��ڣ��� | B�� | ԭ�Ӱ돽���ۣ��ڣ��� | ||
| C�� | �ؓ(f��)�ԣ��ۣ��٣��� | D�� | ����σr���ڣ��٣��� |
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�����}
| ���W(xu��)ʽ | CH3COOH | H2CO3 | HC1O |
| ��xƽ�ⳣ��(sh��) | 1.7��10-5 | K1=4.3��10 K2=5.6��10-11 | 3.0��10-8 |
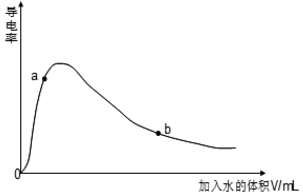
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ��x���}
| A�� | 35Cl��37Cl��ԭ�ӽY(ji��)��(g��u)ʾ��D����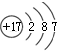 | |
| B�� | HCI���γ��^�̞� 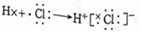 | |
| C�� | ��ϩ�ĽY(ji��)��(g��u)��ʽ��CH2CH2 | |
| D�� | �������x�^�̞�H2C2O4?2H++C2O42- |
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ��Ɣ��}
�鿴�𰸺ͽ���>>
�ٶ����� - ����(x��)���б� - ԇ�}�б�
����ʡ��(li��n)�W(w��ng)�`���Ͳ�����Ϣ�e��ƽ�_ | �W(w��ng)���к���Ϣ�e�^(q��) | ����p�_�e�^(q��) | ��vʷ̓�o���x�к���Ϣ�e�^(q��) | �����֙�(qu��n)�e�^(q��)
�`���Ͳ�����Ϣ�e���Ԓ��027-86699610 �e���]�䣺58377363@163.com